Tincion de azul coomassie para geles de poliacrilamida (PAGE)
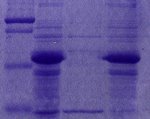

Tincion, decoloracion y secado de geles de poliacrilamida (PAGE)
Para teñir el gel
1). Una vez que ha finalizado la corrida electroforetica, retirar el gel del casette y colocarlo en un recipiente hermetico de plastico (tuper)
2). Añadir 50 mL de la solucion de tincion
3). Incubar a 22 oC, 12 h, en agitacion continua
Para desteñir el gel
1). Incubar en 50 mL de solucion destiñidora durante una hora
2). Repetir el procedimiento dos o tres veces mas hasta que aparezcan las bandas teñidas de azul y el fondo casi transparente
Para secar el Gel
1). Incubar durante 12 h en glicerol al 20% en agua BD.
2). Fotografiar o escanear
3). Secar en el bastidor de acrilico a 22 oC durante dos o tres dias. (se puede acelerar el proceso si se le coloca un foco incandescente de 60 W lo mas cercano posible al gel, pero sin que llege a tocarlo).
Solucion de tincion
1). 2.5 g Azul Brillante Coomassie R-250
2). 450 mL metanol
3). 100 mL acido acetico glacial
4). Aforar a 1 L con agua BD
Nota: Esta solucion se puede recuperar y reusar nuevamnte si se filtra y se mezcla con la solucion de coomassie
Solucion destiñidora
1). 200 mL de metanol
2). 150 mL de acido acetico
3). 650 mL de agua BD
Nota: Esta solucion se puede recuerar y reusar si se filtra con un poco de carbon activado.

9 Comments:
Disculpe a que se refiere con agua BD?
Muchas Gracias
bidestilada!
¿Se puede desteñir "de más" un gel?
Porque obtuve un gel "demasiado" transparente? Aunque sí se distinguen las bandas.
¿Hay algún motivo que explique que no "baje" una muestra en un carril? Se quedó como estancada en la parte superior.
¡Gracias!
Zippo
Agua BD = Agia BiDestilada
-------
Marisol
Gracias.
------
Seven
Si se puede desteñir de "mas", poro puede ser reteñido. Si la proteína "no corrió fue porque posiblemente no estaba bien procesada o desnaturalizada.
Como hace el azul de coomasie para unirse selectivamente a las proteinas adheridas en el gel?
Si está "muy transparente" quiere decir que:
1.- no se tiñó bien
2.- La muestra está MUY diluida o con proteinas ausentes
Y la explicación para que las bandas no "bajen" es por que muy posiblemente estén fuera del rango del peso molecular adecuado para el gel, es decir que la concentracion de acrilamida es mucha y no puden migrar las proteinas por que el tamaño del poro es muy pequeño.
Todo lo que necesiten está aquí... MUY COMPLETO. saludos
http://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6040A.pdf
No afecta la tinción a la transferencia a una membrana de nitrocelulosa?
muchas gracias, muy buen blog, lo consulto seguido:)
hola que tal mucho gusto.
Requiero saber si puedo utilizar papel whatmann número 1 para filtrar el azul de coomasie después de prepararlo. en caso contrario sería tan amable de indicarme que tipo de membrana es la adecuada.
Saludos.
Publicar un comentario
<< Home