En tubo de vidrio borosilicato con tapa de rosca.
1). 100 uL de muestra (la sensibilidad es de unos 0.5 - 10 µg GlcN).
2). 500 uL de HCl 2N
3). Burbuje la solucion con nitrogeno gaseoso
4). Cierre firmemente la tapa del tubo e incube a 100 oC durante 16 horas (use un baño seco, nosotros usamos el de Kit-Lab. El Paso, Texas, USA)
5). Para preparar la curva estandar use glucosaminos en la concentracion de 0 - 20 µg GlcN de una solucion stock de 1.5 mg/mL. (Use 0, 3, 5, 8, 10, 12 uL de la solucion stock y añada agua para aforar a 300 µL. Despues añada 300 µL de HCl 4N para obtener un volumen final de 600 uL y una concentracion de HCL de 2N). Las soluciones de la curva estandard no necesitan de hidrolisis.
6). Una vez finalizada la hidrolisis, tanto a las muestra como a los estandares se le añade 400 uL de Na2CO3 2M (10.6 g en 50 mL con pH - 7 con un ligero exceso de Na2CO3)
7). Agite suavemente
8). Añada 500 uL de acetil-acetona (preparar en fresco) al 2% en Na2CO3 1.5M (15.9 g carbonato de sodio + 2 mL de acetil acetona y agua para aforar a 100 mL).
9). Cierre el tubo firmemente en incube a 100 oC durante 20 min.
10). Enfriar en agua con hielo
11). 1000 uL de etanol
12). 500 uL ml del reactivo de Ehrlich (1 g de p-dimetilaminobenzaldehido en 15 mL de EtOH y 15 mL HCl conc.)
13). Agite en vortex para expeler el exceso de CO2
14). Se formara una coloracion en unos 5 min, y este cromoforo es estable por 1-2 horas.
15). Lea la absorbancia a 530 nm.
NOTA: NaCl afecta e desarrollo del color, es por ello que TODAS muestras y estandares tengan la misma concentracion de sal con el proposito de evitar variaciones en la coloracion. La dialisis ayuda a remover el NaCl pero consume mas tiempo y reactivos, vease DIALISIS.
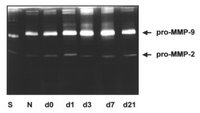
 Electroforesis vertical (para proteinas, zimografia, o como paso previo al Western Blot.
Electroforesis vertical (para proteinas, zimografia, o como paso previo al Western Blot.

